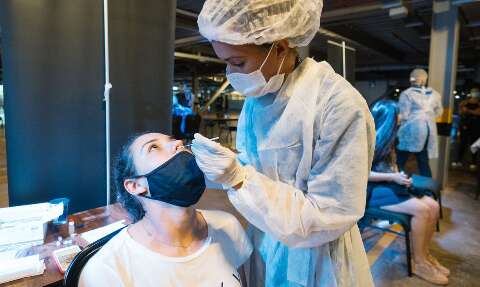
Anvisa autoriza a comercialização de autotestes no Brasil
Liberação foi autorizada durante reunião do colegiado e empresas devem fazer registro do produto na Anvisa
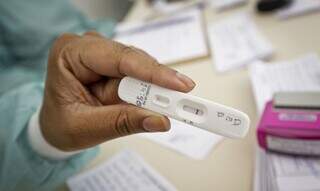
A diretoria colegiada da Anvisa (Agência Nacional de Vigilância Sanitária) aprovou hoje a venda de autotestes diretamente ao consumidor em farmácias e estabelecimentos de saúde licenciados para comercializar dispositivos médicos.
Em nota divulgada pela Anvisa, a informação é que nenhum autoteste poderá ser comercializado imediatamente no País. As empresas habilitadas legalmente que desejarem colocar esses dispositivos à venda terão que registrar o produto na Anvisa.
- Leia Também
- Anvisa pede mais informações para decidir sobre autotestes para covid
- Maioria dos leitores acha que Brasil deveria vender autotestes da covid
A aprovação foi deliberada durante 3ª Reunião Extraordinária Pública de 2022 da diretoria colegiada.
Condições - Entre os requisitos, a Anvisa determina que as instruções de uso, armazenagem e descarte do produto sejam claras e que utilizem ilustrações para facilitar o manuseio e a interpretação do resultado por parte do público leigo, ou seja, por indivíduos sem treinamento técnico ou científico formal para uso do produto.
O solicitante do registro do autoteste deve dispor de um canal de atendimento ao usuário, com acesso direto a pessoal capacitado para atender, orientar e encaminhar as demandas sobre o uso do produto e como proceder após a obtenção do resultado. Além de disponibilizar o contato desse serviço de atendimento, a empresa deve indicar o Serviço Disque Saúde do Ministério da Saúde, em conformidade com o Plano Nacional de Expansão da Testagem para Covid-19, o PNE-Teste.
Com relação à embalagem, o rótulo externo do produto deve conter todos os componentes do kit, que são necessários para a realização do teste, e também a validade do dispositivo, de modo a evitar seu uso fora do prazo de validade.
Monitoramento - Os autotestes estão sujeitos ao monitoramento pós-comercialização por meio do Sistema de Notificação e Investigação em Vigilância Sanitária, o Vigipós.
O detentor do registro deve se responsabilizar por todas as ações de vigilância pós-comercialização do produto, em todo seu ciclo de vida. Isso inclui o estabelecimento de mecanismos para monitorar e notificar queixas técnicas e eventos adversos, recolhimento do produto quando determinado pela Anvisa ou sempre que houver indícios suficientes de que o dispositivo não atende aos requisitos de qualidade, segurança e desempenho e também notificação de ações de campo decorrentes de eventos adversos associados ao produto.
O setor varejista, por sua vez, deve notificar os eventos adversos e queixas técnicas no Sistema de Notificações em Vigilância Sanitária, o Notivisa. No caso de o usuário notificar problemas relacionados ao uso do produto diretamente à Anvisa, o responsável pelo registro deverá avaliar e responder a demanda no sistema informatizado disponibilizado pela agência.